질병관리청 국립보건연구원이 추진하는 ‘팬데믹 대비 mRNA 백신 개발 지원 사업’ 과제수행기관의 코로나19 mRNA 백신 후보물질이 12월 18일 식품의약품안전처로부터 임상 1상 시험계획 승인을 받아 임상시험에 착수한다고 밝혔다.
◆민관 협력 mRNA 백신 국산화 첫 성과
이번 승인은 메신저리보핵산(mRNA) 기술을 활용해 국산 코로나19 백신을 신속하게 개발하고, 향후 발생할 수 있는 새로운 감염병에 빠르게 대응할 수 있는 백신 개발 체계(플랫폼)를 구축하기 위한 연구개발 사업의 첫 번째 성과다.
정부는 지난 4월부터 mRNA 기술을 보유한 기관을 중심으로 비임상 과제 등을 지원해왔으며, 과제수행기관인 GC녹십자가 식약처에 코로나19 mRNA 백신 후보물질의 임상시험계획을 신청한 후 보완 절차를 거쳐 임상 1상 임상시험계획(IND) 승인을 받았다.
총사업비 5052억 원(국비 3379억 원, 민간 1673억 원) 규모의 이번 지원사업은 예비타당성조사 면제 사업으로, 2025년부터 2028년까지 4년간 진행된다.
◆건강한 성인 대상 안전성·면역원성 검증
질병청은 코로나19 mRNA 백신 후보물질의 제품화를 목표로 과제수행기관과 협력하여 건강한 사람을 대상으로 안전성과 면역원성 등을 검증하는 임상 1상 시험을 추진한다.
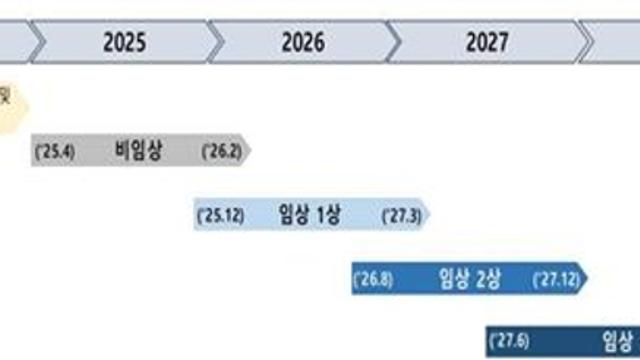
▲임상단계별로 진행
임상 1상은 2025년 12월부터 2027년 3월까지 진행될 예정이며, 이후 임상 2상(2026년 8월~2027년 12월), 임상 3상 및 품목허가(2027년 6월~2028년 12월) 단계로 이어진다.
정부는 식약처 등 관련부처와 협력하여 집중적으로 규제·재정·기술을 지속 지원한다는 계획이다.
비임상부터 임상 3상까지 시료생산과 공정 개발을 포함한 패키지 지원이 이루어진다.
▲2028년까지 플랫폼 완성 목표
이번 사업의 목표는 mRNA 기술을 활용한 백신 신속개발 플랫폼을 완성하여 미래 팬데믹 위기 시 최대 200일 내 초고속 백신 개발을 추진하는 것이다. mRNA 플랫폼을 보유하면 항원 교체만으로 3~6개월 만에 새로운 백신 개발이 가능하다.
당장은 향후 매년 예방접종이 예상되는 코로나19를 대상으로 mRNA 백신을 개발하고 품목허가까지 진행하여 제품화 및 mRNA 백신 플랫폼을 완성한다는 계획이다.
임상 단계별 소요시간을 최적화하고 중첩 진행하는 등의 방식을 통해 2028년까지 개발을 완료한다는 목표다.
◆감염병 넘어 암·희귀질환까지 확대 적용
임승관 질병관리청장은 “이번 mRNA 백신의 임상 승인은 코로나19 백신 국산화를 위해 민간과 정부가 함께 이뤄낸 중요한 성과”라며 “앞으로도 연구가 성공적으로 진행될 수 있도록 부처 간 협업과 지원을 아끼지 않겠다”고 밝혔다.
이어 “mRNA 플랫폼의 확보는 코로나19뿐만 아니라 향후 다양한 감염병과 암 백신, 희귀질환 치료제 등에 활용될 수 있는 만큼 질병관리청은 임상 1상 과제의 성공을 위한 다부처 협업 등 다각도의 지원을 아끼지 않을 것”이라고 강조했다.
[메디컬월드뉴스]